
درس و تحقیق در وبلاگ شُکری
کتاب درسی+تحقیق+نمونه سوالات (دوره متوسطه اول)
درس و تحقیق در وبلاگ شُکری
کتاب درسی+تحقیق+نمونه سوالات (دوره متوسطه اول)من را بشناسید
نظرسنجی
نظرسنجی
نظرسنجی
دستهها
برگهها
جدیدترین یادداشتها
همه- کد هدیه و تخفیف مخصوص وبلاگ ما برای اسنپ
- دانلود نرم افزار وبلاگ
- خلاصه ای از سرگذشت« هِلِن کِلِر»
- خلاصه ای از سرگذشت« هِلِن کِلِر»
- پاورپوینت های علوم نهم
- کوئیز زبان انگلیسی هشتم | درس 4: My Health
- کوئیز زبان انگلیسی هشتم | درس 2: My Week
- کوئیز زبان انگلیسی هشتم | درس 1
- کوئیز زبان انگلیسی هشتم | درس 3: My Abilities
- به وبلاگ ما خوش آمدید
- برنامه ها اندروید درسی (دانلود از بازار)
- عکس جدول تناوبی (مندلیف) با معنی فارسی
- جدول مندلیف و معانی فارسی عناصر
- پاسخ فعالیت های اجتمایی
- پاورپوینت های درس 1 تا 20مطالعات اجتماعی هشتم
- روش های پیشگیری از گاز گرفتگی و مسمومیت با مونوکسید کربن
- جدول صرف فعل های ماضی و مضارع ثلاثی مجرد و ضمایر متصل و منفصل
- فیلم های کوتاه درس تفکر و سبک زندگی دوره دوم متوسطه (هشتم)
- دانلود کتاب های نهم (pdf) رایگان سال تحصیلی 95-94
- ,وبلاگی کامل برای درس کار و فنّاوری
- آموزش افعال ماضی و مضارع عربی
- پاور پوینت آموزش درس اول علوم هشتم متوسطه(مخلوط و جداسازی مواد)
- پاور پوینت درس دوم علوم هشتم متوسطه(تغییرهای شیمیایی در خدمت زندگی)
- پاور پوینت آموزش درس ۳ علوم هشتم
- پاور پوینت آموزش درس ۴ علوم هشتم (دستگاه عصبی)
- پاور پوینت آموزش درس ۵ علوم هشتم (حس و حرکت)
- دانلود پاسخ خودارزیابی های درس اول فارسی پایه هشتم
- مفهوم شعر های فصل 1 فارسی هشتم
- ***پندی چو یک قند***
- روستای آقچای در همدان
- فایل آموزش درس ۶ علوم هشتم (تنظیم هورمونی)
- جدول تناوبی عناصر چیست ؟ ( جدول تناوبی عناصر به زبان ساده )
- جوک جدید
- پاور پوینت آموزش درس ۷ علوم هشتم (الفبای ژنتیک)
- آموزش فصل ۸ علوم پایه هشتم متوسطه (تولید مثل در جانداران)
- آموزش فصل ۹ علوم پایه هشتم متوسطه (الکتریسیته)
- نمونه سوال پیام های آسمان (کل کتاب)
- نمونه سوالات تستی علوم هشتم
- ارزشیابی دوره ای علوم تجربی پایه هشتم | فصل 1 تا 13
- آزمون فصل اول تا هشتم ریاضی هفتم
- نمونه سوالات ریاضی پایه هفتم یادآوری مطالب در تعطیلات نوروزی
- نمونه سوالات ریاضی هفتم - خرداد 94
- تحقیق علوم
- نمونه سوال فصل به فصل ریاضی هشتم
- نمونه سوالات ریاضی هشتم + پاسخ
- مکان های تاریخی از زمان ایران باستان
- تحقیق با موضوع : ورزش
- میکروسکپ
- سوالات متن کتاب مطالعات هشتم
- سوالات مهم اجتمایی هفتم
نویسندگان
بایگانی
- خرداد 1396 1
- اسفند 1395 1
- آبان 1395 3
- دی 1394 4
- آذر 1394 4
- آبان 1394 1
- مهر 1394 40
- شهریور 1394 5
- خرداد 1394 11
تقویم
خرداد 1396| ش | ی | د | س | چ | پ | ج |
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 | 31 |
جستجو
جدول تناوبی عناصر چیست ؟ ( جدول تناوبی عناصر به زبان ساده )
در نگاه نخست جدول تناوبی بسیار پیچیده به نظر می رسد . جدول تناوبی در حقیقت ، جدولی بزرگ از همه ی عنصر های موجود است که در آن عنصر ها به ترتیب عدد اتمی ردیف شده اند ...
در نگاه نخست جدول تناوبی بسیار پیچیده به نظر می رسد . جدول تناوبی در حقیقت ، جدولی بزرگ از همه ی عنصر های موجود است که در آن عنصر ها به ترتیب عدد اتمی ردیف شده اند . عدد اتمی ، تعداد پروتون هایی است که هر اتم در هسته ی خود دارد . با قرار دادن عنصر ها به این شیوه ، عنصرهایی که خواص مشابه دارند در یک گروه قرار می گیرند . مانند هر جدول دیگری ، این جدول نیز ردیف هایی دارد که از چپ به راست و ستون هایی دارد که از بالا به پایین مرتب شده اند . ردیف های جدول تناوبی دوره تناوب و ستون های آن گروه نامیده می شود .

در ادامه مطلب بیشتر با این جدول آشنا خواهید شد .
منبع:وبلاگ در جستجوی علوم
دیمیتری مندلیف شیمیدان روس معتقد بود که در عنصر ها نظمی وجود دارد . او درباره ی همهی عنصر های شناخته شده تا آن زمان اطلاعاتی جمع آوری کرد و در سال 1869 میلادی جدولی از عنصرها انتشار داد که جدول تناوبی حال حاضر بر اساس آن شکل گرفته است . کار ارزشمند و مهم مندلیف در طراحی جدول این بود که او برای عنصرهایی که پیش بینی می کرد در آینده کشف شوند ، جای خالی قرار داده بود . به عنوان مثال یکی از عنصرهایی که مندلیف جای ان را در جدول تناوبی خالی گذاشت ، گالیم ( عنصر 31 ) بود مندلیف آن را اکاـ آلومینیوم نامید ؛ چون پیش بینی می کرد خواص شیمیایی این عنصر مشابه آلومینیوم باشد . در سال 1875 دانشمند فرانسوی ، لوکوک دو بو ابودران ، گالیم را کشف کرد . این عنصر دقیقاً همان خواصی را داشت که مندلیف پیش بینی می کرد .

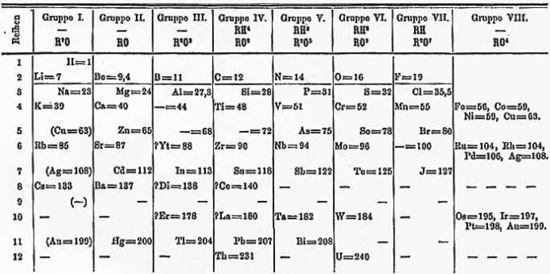
جدول طراحی شده توسط مندلیف
در نگاه نخست جدول تناوبی بسیار پیچیده به نظر می رسد . جدول تناوبی در حقیقت ، جدولی بزرگ از همه ی عنصر های موجود است که در آن عنصر ها به ترتیب عدد اتمی ردیف شده اند . عدد اتمی ، تعداد پروتون هایی است که هر اتم در هسته ی خود دارد . با قرار دادن عنصر ها به این شیوه ، عنصرهایی که خواص مشابه دارند در یک گروه قرار می گیرند . مانند هر جدول دیگری ، این جدول نیز ردیف هایی دارد که از چپ به راست و ستون هایی دارد که از بالا به پایین مرتب شده اند . ردیف های جدول تناوبی دوره تناوب و ستون های آن گروه نامیده می شود .
هیدروژن ( H ) نخستین عنصر جدول تناوبی عناصر است ، چون فقط یک پروتون در هسته ی خود دارد . هلیم ( He) دمین عنصر است ، چون دو پروتون دارد و سایر عنصرها نیز به همین ترتیب مرتب شده اند . جدول تناوبی می تواند رنگ بندی شود معمولاً هر دسته ای با رنگی ویژه مشخص می شود تا تمامی عنصرهایی که به یک دسته تعلق دارند ، به راحتی شناخته شوند . چنانچه عنصرهای جدول تناوبی رنگ بندی شوند ، 9 دسته مختلف را نشان می دهند . هیدروژن به هیچ کدام یک از این دسته ها تعلق ندارد .

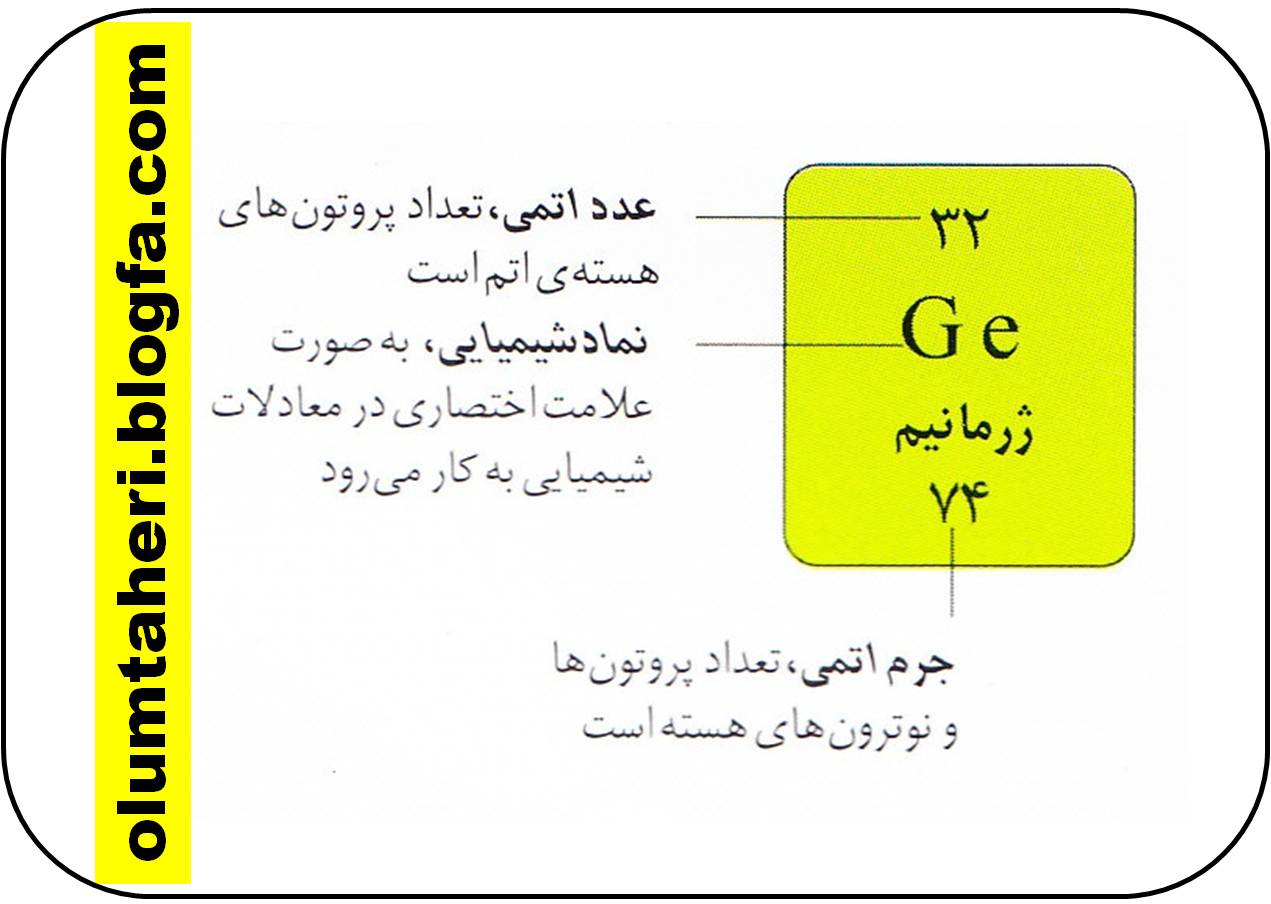
علامت اختصاری
هر عنصر به غیر از نام ، یک علامت اختصاری هم دارد که به ان نماد شیمیایی گفته می شود که شیوه ی تند نویسی عنصر در معادلات شیمیایی است . نماد شیمیایی اغلب حرف اول یا دو حرف اول اسم آن عنصر است . هر عنصر عدد اتمی و جرمی مخصوص به خود را دارد.
گروه
جدول تناوبی 18 گروه دارد .گروه اول ( که گروه فلزات قلیایی نامیده می شود ) آخرین ستونی است که در سمت چپ جدول قرار گرفته است . عنصرهای این گروه دارای خصوصیاتی مشابه اند ، ولی غیر یکسان هستند . چون تعداد الکترون های لایه ظرفیت ( الکترون های آخرین لایه اتم ) در همه عناصر یک گروه مشابه است ، اگر بدانیم یک عنصر در چه گروهی قرار دارد ، می توانیم اطلاعات زیادی راجع به آن به دست آوریم .
در هر گروه هر چه پایین تر برویم ، تعداد پروتون ها و نوترون ها داخل هسته افزایش می یابد و یک لایه جدید الکترونی نیز به آن اضافه می شود . این ذرات اضافی اتم را سنگین تر می کنند و لایه اضافی حجم اتم را بالا می برد .
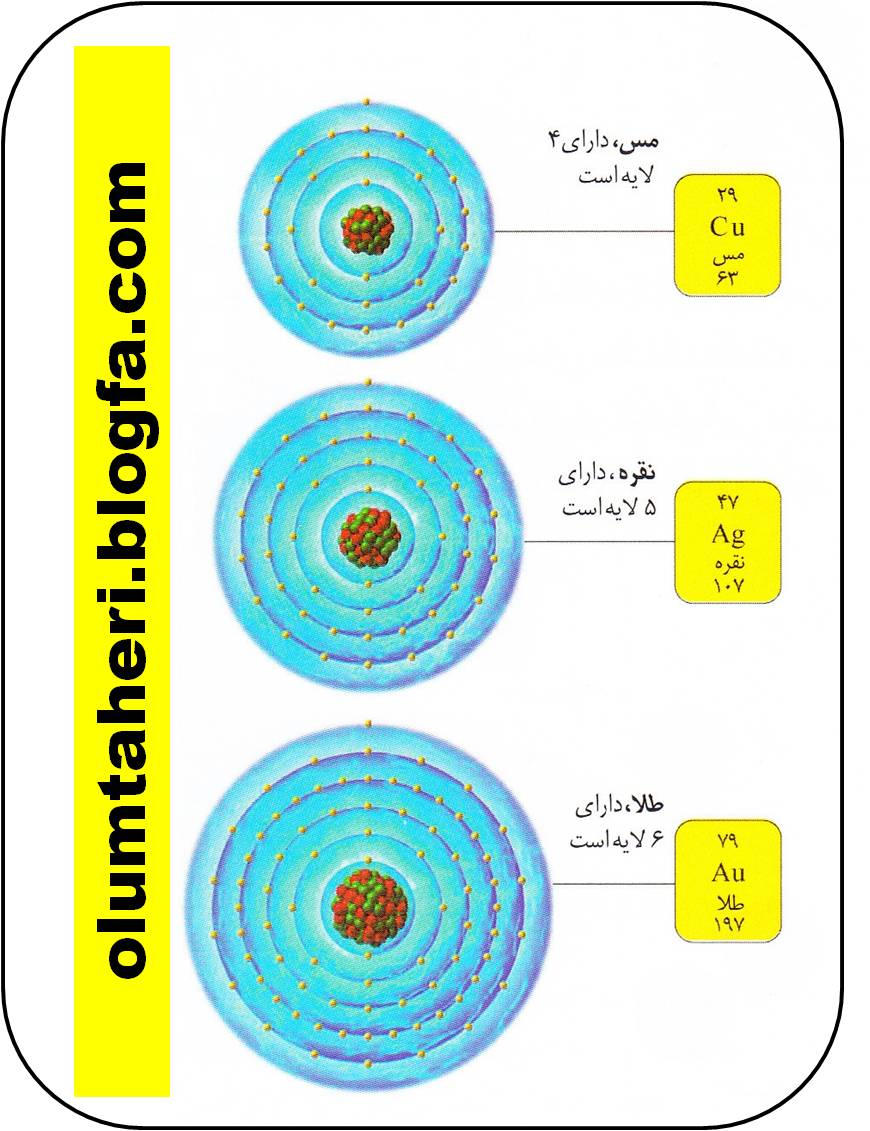
برای مشاهده تصویر با کیفیت و بزرگ بالا اینجا را کلیک کنید
دوره تناوب
خواص عنصرها در یک تناوب (ردیف ) به تدریج تغییر می کند . نخستین و آخرین عنصر هر تناوب ، تفاوت زیادی با یکدیگر دارند . نخستین عنصر هر دوره ماده ی جامد واکنش زا است و در ترکیب با اکسیژن می سوزد و آخرین عتصر هر دوره یک گاز بی اثر است . البته همه ی عنصرهای یک تناوب دارای تعداد لایه های الکترونی مشابه هستند ، مثلاً تمامی عنصرهای تناوب سوم ، سه لایه دارند .
همانطور که در طول تناوب حرکت می کنیم ، اتم ها سنگین تر اما کوچکتر می شوند ؛ به این دلیل که تعداد لایه های الکترونی یکسان باقی می ماند ، اما تعداد پروتون ها و نوترون ها در هسته افزایش می یابد . نیروی قوی و جاذبه ی پروتون های مثبت ، الکترون های منفی را با شدتی بیشتر به وی مرکز می کشاند .

